ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物 。
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列 。
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(4)Se原子基态核外电子的排布式为 ;H2Se的沸点:-41.1℃ ,H2S的沸点:-60.4℃,引起两者沸点差异的主要原因是 ;
(5)SO32-离子中硫原子的杂化方式 ,该离子的立体构型为 ;
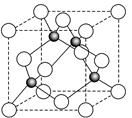
(6)某金属元素A的氧化物用作玻璃、瓷器的颜料、脱硫剂。其立方晶体的晶胞结构如右图所示,
则该氧化物的化学式为 。
(12分)[(4)、(5)两题每空1分,其余每空2分]
(1)CS2或N2O (2)SiO2>Na2O>P2O5 (3) O>S>Se
(4)1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4 H2Se分子之间的作用力强于H2S
(5) sp3;三角锥形 (6) AO
题目分析:(1)原子数和价电子数分别都相等的互为等电子体,CO2含有3个原子、4+6×2=16个价电子数,所以与CO2等电子的化合物是CS2或N2O。
(2)Na2O、SiO2、P2O5三种氧化物形成的晶体类型分别是离子晶体、原子晶体和分子晶体,所以三种氧化物按熔沸点由高到低顺序排列是SiO2>Na2O>P2O5。
(3)非金属性越强,第一电离能越大。根据元素周期律可知,同主族元素自上而下非金属性逐渐减弱,即O、S、Se三种元素的非金属性强弱顺序是O>S>Se,所以三种原子的第一电离能由大到小的顺序为O>S>Se。
(4)Se元素的原子序数是34,所以根据构造原理可知,Se原子基态核外电子的排布式为1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4;由于H2Se和H2S分子形成的晶体类型均是分子晶体,而H2Se分子之间的作用力强于H2S,所以H2Se的分子沸点高于H2S的沸点。
(5)根据价层电子对互斥理论可知,SO32-离子中硫原子含有的孤对电子对数=(6+2-3×2)÷2=1,所以该离子的空间构型是三角锥形,而硫原子的杂化方式是sp3。
(6)根据晶胞结构并借助于均摊法可知,晶胞中含有的白球个数=8×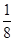 +6×
+6×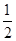 =4个,而黑球全部在晶胞内,其个数=4个,所以该氧化物的化学式是AO。
=4个,而黑球全部在晶胞内,其个数=4个,所以该氧化物的化学式是AO。
