现有一包白色粉末,已知它们可能由Na2SO4、NaCl、Na2CO3、CuSO4中的一种或几种组成,某学生的实验过程记录如下:
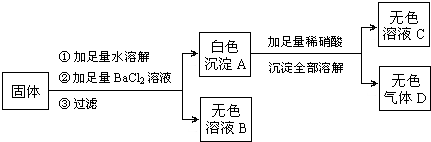
试回答:
(1)白色沉淀A的化学式为______,无色气体D的化学式为______.
(2)由上述实验记录推断:原固体一定含有______,一定不含有______,可能含有______.
(3)请你设计实验方案,验证上述可能含有的物质是否一定存在(写出具体操作步骤、现象和结论)______.
结合实验的过程可得以下结论:①因为第一次反应生成白色沉淀和无色溶液,故可判断肯定没有CuSO4,因为有铜离子的溶液都是蓝色或蓝绿色;
②加适量氯化钡溶液,生成白色沉淀A且沉淀可溶于稀硝酸,说明此白色沉淀A为BaCO3沉淀而不是BaSO4;又因为在所给的四种物质中,只有Na2CO3含有碳酸跟离子,故可判定粉末中一定有Na2CO3,一定没有Na2SO4;故无色溶液B中的溶质为NaCl;
③由②的分析可知,白色沉淀A为碳酸钡,与稀硝酸反应,生成硝酸钡、水和二氧化碳气体,故可判断无色溶液C为硝酸钡溶液,无色气体D为CO2;
综上所述该物质中一定含有碳酸钠,一定不含硫酸铜、硫酸钠,可能含有氯化钠;
如果要鉴定溶液中是否含有氯化钠可采用的方式有多种:①取少量固体溶于水(取样)②加入足量稀硝酸,再加入AgNO3溶液③观察有无白色沉淀生成,由此得出结论(或①取少量固体溶于水(取样)②加入AgNO3溶液再加入足量稀硝酸③观察最终有无白色沉淀生成,由此得出结论;或者①取少量固体溶于水(取样)②加足量的Ba(NO3)2溶液,充分反应,过滤;取滤液加入AgNO3溶液③观察有无白色沉淀生成,由此得出结论;
故答案为:(1)BaCO3;CO2. (2)Na2CO3;Na2SO4、CuSO4;NaCl;
(3)①取少量固体溶于水(取样)②加入足量稀硝酸,再加入AgNO3溶液③观察有无白色沉淀生成,由此得出结论( 或者①取少量固体溶于水(取样)②加入AgNO3溶液再加入足量稀硝酸③观察最终有无白色沉淀生成,由此得出结论;或者①取少量固体溶于水(取样)②加足量的Ba(NO3)2溶液,充分反应,过滤;取滤液加入AgNO3溶液③观察有无白色沉淀生成,由此得出结论);
