某学习小组在实验室模拟侯氏制碱法制备纯碱,其实验流程如下:
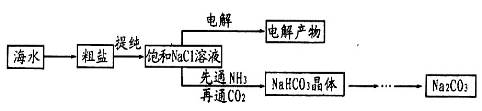
请回答下列问题:
(1)食盐溶液中含SO42-等杂质,不能用于除去SO42-的试剂是_________(填序号)。
a. Ba(OH)2 b.Ba(NO3)2 c. BaCl2 d. Na2CO3
(2)实验制备碳酸氢钠用到下列装置:

①实验装置中各接口的连接是d接____,e接_____,c接f。实验过程中先通入氨气的原因_____________。
②析出晶体后的溶液中含有大量的NH4+,检验NH4+的方法是__________________。
③瓶g内的溶液是___________________________________________。
(3)由碳酸氢钠制备纯碱的过程中用到的主要仪器除酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(4)用图电解饱和NaC1溶液的方法来制取NaOH、C12和H2。

①反应中生成的C12从_______(填“A”或“B”)放出,检验C12所用试剂(用品)______________________。
②经过长时间电解后,向电解液中滴加酚酞试液,发现溶液并未变红色,试分析可能的原因__________。
(14分)(1)bd(2分) (2)①b a(2分);氨气溶解度大,先通入氨气使溶液显碱性,增大CO2的吸收量,增大HCO3-的浓度(2分) ②取适量溶液于试管中,加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝(2分) ③饱和碳酸氢钠溶液
(3)坩埚、坩埚钳(1分)(未答出坩埚钳不给分)
(4)①B(1分);淀粉碘化钾溶液或湿润的淀粉碘化钾试纸(1分)
②电解生成的氯气会与NaOH充分反应,导致电解最终产物仅是NaClO和H2。NaClO具有强氧化性,将酚酞氧化,故溶液不变红色(2分)
题目分析:(1)由于在除杂时不能再引入新的杂质,所以要除去食盐溶液中含有SO42-等杂质,可以选择氢氧化钡或氯化钡,而不能选择硝酸钡或碳酸钡,答案选bd。
(2)①根据装置特点可知,A装置是制备碳酸氢钠的,B装置是制备CO2的,C装置是制备氨气的,D装置是吸收多余的氨气。由于氨气极易溶于水,所以氨气要通过a口通入到装置A中,所以正确连接顺序是d接b,e接a,c接f。由于氨气溶解度大,先通入氨气使溶液显碱性,增大CO2的吸收量,从而增大HCO3-的浓度,便于碳酸氢钠晶体析出。
②铵盐能和强碱反应生成氨气,可以通过检验氨气来检验NH4+,所以正确操作是取适量溶液于试管中,加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。
③由于盐酸易挥发,所以生成的CO2中含有氯化氢,而氯化氢能和氨气反应,所以小于除去CO2中的氯化氢气体,因此瓶g内的溶液是饱和碳酸氢钠溶液。
(3)碳酸氢钠加热分解即生成碳酸钠,而固体加热需要在坩埚中进行,所以还缺少的仪器是坩埚和坩埚钳。
(4)①根据装置图可知,A和电源的负极相连,做阴极,溶液中的氢离子放电生成氢气。B和电源的正极相连,做阳极,溶液中的氯离子放电生成氯气,所以氯气在B电极生成。氯气具有强氧化性,能使湿润的淀粉碘化钾试纸变蓝色,据此可以检验氯气,因此检验C12所用试剂(用品)是淀粉碘化钾溶液或湿润的淀粉碘化钾试纸。
②由于电解生成的氯气会与NaOH充分反应,因此长时间电解后会导致电解最终产物仅是NaClO和H2。NaClO具有强氧化性,将酚酞氧化,故溶液不变红色。2和氨气的制备;仪器的选择;NH4+和氯气的检验;电解饱和食盐水的有关判断等
