(16分)某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
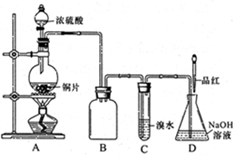
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定 b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值 d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMNO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
(共16分)
(1)Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O(2分)
防止C中液体倒吸入A中(或防倒吸,或安全瓶)(2分)
(2)还原(2分) 溶液红色褪去(2分)
(3)b c(2分)
(4)①溶液变为蓝色(1分) ②溶液褪色(1分)
③Ⅰ或Ⅲ(2分) ④Ⅰ或Ⅱ(2分)
题目分析:(1)Cu与浓硫酸加热生成CuSO4、SO2和H2O,化学方程式为:Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O;因为SO2易溶于水,而且SO2能与溴水反应,容易产生倒吸,所以装置B的作用是:防止C中液体倒吸入A中。
(2)装置C中盛有溴水,具有较强的氧化性,设计装置C的目的是验证SO2的还原性;若NaOH全部转化为NaHSO3,不能与SO2反应,通入的SO2具有漂白性,能使品红褪色,所以D中NaOH全部转化为NaHSO3的标志是:溶液红色褪去。
(3)反应后的溶液含有CuSO4,由于溶液中有铜离子使溶液呈蓝色,不能指示反应的终点,所以不能用酸碱中和滴定法测定剩余酸的物质的量的浓度;CuSO4能与BaCl2反应生成BaSO4沉淀,所以不能用与足量BaCl2溶液反应,称量生成沉淀的质量的方法测剩余H2SO4的量;根据与足量Zn反应,测量生成H2的体积、用PH计测溶液PH值可以求出剩余H2SO4的量,故bc正确。
(4)①漂白粉过量,过量的漂白粉把KI氧化为I2,使淀粉溶液变蓝。
②漂白粉不足,剩余NaHSO3,棕红色的KI3溶液氧化NaHSO3,生成无色的KI,所以现象为:溶液褪色。
③滴入加少量酸性KMNO4溶液,振荡,溶液呈紫色,说明NaHSO3已完全反应,可能为I. HSO3-与ClO-刚好反应完或III. 漂白粉过量。
④若HSO3-与ClO-刚好反应完,可生成HCl,能与CaCO3反应生成气泡;NaHSO3呈酸性,能与CaCO3反应生成CO2,所以I. HSO3-与ClO-刚好反应完、II. 漂白粉不足能与CaCO3反应生成气泡。
