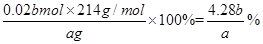某化学小组为测定加碘盐中KIO3的质量分数,进行了如下实验。
已知:KIO3 + 5KI + 3H2SO4= 3K2SO4 + 3I2 + 3H2O
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配制溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量的KI溶液;
步骤三:用bmol·L-1 Na2S2O3溶液的溶液滴定步骤二所得溶液至终点,记录数据;再重复滴定2次,平均消耗Na2S2O3溶液的体积为12.00mL。
(1)步骤一中配制250mL溶液,所用到的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还有 。
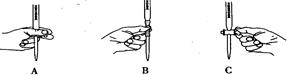
(2)步骤三中进行滴定的过程中下列哪个操作正确 ,
选择 作为指示剂,到达滴定终点时的现象为 。
(3)实验测得此加碘盐中KIO3的质量分数= (KIO3的相对分子质量为214)。
(1)250mL容量瓶
(2)B 淀粉
当滴入最后一或半滴Na2S2O3溶液时,溶液的蓝色褪去,且半分钟内溶液不恢复蓝色。
(3)(4.28b)/a × 100%
题目分析:(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:250mL容量瓶,故答案为:250mL容量瓶;
(2)硫代硫酸钠显碱性,应使用碱式滴定管,因此选B。硫代硫酸钠遇到碘单质被碘氧化,可以使碘变成碘离子,因此使用淀粉作指示剂。到达滴下终点时的现象为:当滴入最后一或半滴Na2S2O3溶液时,溶液的蓝色褪去,且半分钟内溶液不恢复蓝色。
(3)25mL溶液消耗Na2S2O3的物质的量为b mol•L-1×0.012L=0.012mol,故250mL溶液应消耗Na2S2O3的物质的量为0.012bmol×10=0.12bmol,令250mL溶液中KIO3的物质的量为xmol,则:
KIO3~~~~3I2~~~~6Na2S2O3
1 6
xmol 0.12bmol
所以x=0.02b
故加碘盐中KIO3的质量分数: