某班同学用如图所示的装置测定空气里氧气的含量。药匙上放少量钠,烧杯中装满水,先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。
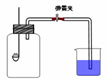
(1)写出燃烧匙中发生反应的化学方程式: ,将该生成物伸入瓶底的水中,生成的氧化产物与还原产物物质的量之比为: 。
(2)实验完毕,广口瓶内水面上升明显小于空气体积的1/5,对这一现象解释正确的是:
a.该同学可能未塞紧瓶塞,导致钠熄灭时外界空气进入瓶内
b.该同学可能使用钠的量不足
c.该同学可能没夹紧弹簧夹,钠燃烧时部分空气受热从导管逸出
d.该同学可能插入燃烧匙太慢,塞紧瓶塞前瓶内部分空气受热逸出
(1)2Na+O2 Na2O2;1:2 (2)ab
Na2O2;1:2 (2)ab
题目分析:该实验利用金属钠燃烧消耗集气瓶集气瓶内氧气,压强减小,回复室温后,打开弹簧夹,烧杯内的水进入集气瓶,水的体积就是消耗掉氧气的体积。金属钠燃烧反应生成Na2O2,2Na2O2+2H2O=4NaOH+O2,Na2O2既是氧化剂又是还原剂,氧化产物是氧气,NaOH有一半是还原产物,氧化产物与还原产物物质的量之比为1:2,最后水的体积小,说明所测结果体积偏小,a导致外界空气进入装置,倒流回去的水偏少,正确;b、钠不足,没有把氧气消耗完,所测体积少,正确;c、空气溢出,水倒流的应该更多,错误;d、空气溢出,水倒流的应该更多,错误。
