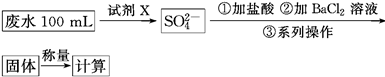
某废水样品中含有一定量的K+、HCO3—、SO32—,甲、乙两研究小组欲测定其中SO32—的浓度。
甲组方案:
乙组方案:
①用烧杯盛取废水适量,加适量活性炭除色;过滤,取滤液。
②精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定(有关反应为2MnO4—+5SO32—+6H+=2Mn2++5SO42—+3H2O)。
③记录数据,计算。
(1)甲组方案中的“试剂X”可选用________。
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 KOH溶液
c.新制氯水
d.NaI溶液
(2)甲组方案中,加入试剂X后生成SO42—的离子方程式为________________。
(3)甲组方案中,第③步的“系列操作”包含的操作名称依次为__________________。
(4)为乙组方案设计的下列滴定方式中,最合理的是________(填字母序号),达到滴定终点时可观察到的现象是__________________。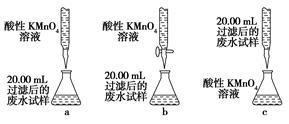
(1)c
(2)SO32—+Cl2+H2O=SO42—+2Cl-+2H+
(3)过滤、洗涤、干燥
(4)b 溶液由无色变为紫红色
(1)加入试剂X后所得溶液中含有SO42—,故试剂X为氧化剂,排除选项b、d;由于最后需要测定SO42—,故不能用含有SO42—的高锰酸钾溶液,排除a;新制氯水具有氧化性,且对后续定量实验没有影响,合理选项为c。(2)新制氯水中含有Cl2,能够将SO32—氧化为SO42—,而本身被还原为Cl-。(3)经第①步、第②步操作后产生沉淀,故第③步操作为过滤,然后对滤渣进行洗涤,干燥。(4)高锰酸钾具有强氧化性,容易腐蚀碱式滴定管的橡胶管,故高锰酸钾应该用酸式滴定管盛装,a错;乙组方案第②步中提示“精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定”,故锥形瓶中应盛装废水试样,而滴定管中应该盛高锰酸钾溶液,c错。