某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
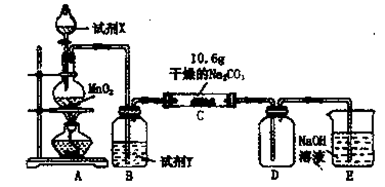
(1)A中制取Cl2的离子方程式 .
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
 (3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(1)2Cl- + 4H+ + MnO2 Mn2+ + Cl2↑+ 2H2O;
Mn2+ + Cl2↑+ 2H2O;
(2)①NaCl;NaCl和Na2CO3;
②
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | 无明显现象 |
| 步骤2:向A试管中滴加BaCl2溶液 | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中无明显现象,则假设1成立,结合步骤2中溶液变浑浊,则假设2成立. |
题目分析:(1)A中制取Cl2的离子方程式为2Cl- + 4H+ + MnO2 Mn2+ + Cl2↑+ 2H2O;
Mn2+ + Cl2↑+ 2H2O;
(2)①假设一、根据氧化还原反应理论,D中含Cl2O,氯元素为+1价;C中只含1种氯盐,则该氯盐中的氯元素的化合价应为-1价,所以另一种成分是氯化钠;假设二、除碳酸氢钠、氯化钠外第三种物质就是剩余的碳酸钠;
②根据2个假设所做的实验,结合假设判断步骤2中向A试管中滴加适量BaCl2溶液,目的是检验产物中是否有Na2CO3,a.若无明显现象,证明固体中不含Na2CO3;b.若溶液变浑浊,证明固体中含Na2CO3;步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒;
(3)C中有0.1mol Cl2参加反应.装置C中通入一定量的氯气后,D中只有Cl2O一种气体,若假设一成立,反应为Cl2+Na2CO3→NaHCO3+NaCl+Cl2O,根据得失电子守恒配平即可。
