(13分)硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) |
| 探究①A. B.向pH=2的硫酸中滴加Na2S2O3溶液 | a.溶液pH=8 b. | i. ii. S2O32-+2H |
| 探究②C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii. |
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质 。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由: 。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是 。
A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸上,并与标准比色卡对照(1分)
i. S2O32-+H2O HS2O3-+OH-(2分)
HS2O3-+OH-(2分)
B. 有淡黄色沉淀(1分),有无色刺液性气味气体产生(1分)
iii. S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+(2分)
探究①:Na2S2O3溶液呈碱性(1分),能与强酸反应(1分)。
探究②:Na2S2O3具有还原性(1分),不相似(1分)。
【问题与讨论】(1)不正确,因为氯水中含有Cl-(1分)。
(2)取少量探究②反应后的溶液,向其中滴入BaCl2溶液,若有白色沉淀,则说明Na2S2O3被氯水氧化。(1分)
题目分析:A.根据实验现象可知,该步操作是测定溶液pH值的,因此正确的操作应该是用玻璃棒蘸取Na2S2O3溶液点在pH试纸上,并与标准比色卡对照。
i.溶液显碱性,说明酸根水解,离子方程式为S2O32-+H2O HS2O3-+OH-。
HS2O3-+OH-。
B.根据反应的生成物有单质硫和 二氧化硫生成可知,实验现象为有淡黄色沉淀,有无色刺液性气味气体产生。
iii.氯水颜色变浅说明发生了氧化还原反应,即硫代硫酸钠被氧化,则反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+。
根据实验操作以及实验现象可知探究①是探究Na2S2O3溶液呈碱性,能与强酸反应。探究②是探究Na2S2O3具有还原性。由于硫酸钠不能与强酸反应,也没有还原性,所以二者的性质不相似。
【问题与讨论】(1)因为氯水中含有Cl-也能与硝酸银溶液反应产生白色沉淀,因此结论是不正确的。
(2)由于氧化产物是硫酸钠,因此可以通过验证硫酸根的生成即可,则实验操作为取少量探究②反应后的溶液,向其中滴入BaCl2溶液,若有白色沉淀,则说明Na2S2O3被氯水氧化。

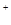 =S↓ +SO2↑ +H2O
=S↓ +SO2↑ +H2O