(9分)硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
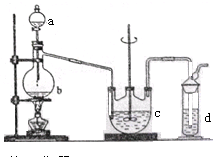
(1)b中反应的离子方程式为__________________,c中试剂为_____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
(1)SO32-+2H+= H2O +SO2↑;或HSO3-+H+=SO2↑+H2O;硫化钠和碳酸钠的混合溶液
(2)硫(3)NaOH溶液 (4)控制反应温度、调节酸的滴加速度(或调节酸的浓度等)
(5)若SO2过量,溶液显酸性,产物分解
题目分析:(1)装置b是制取SO2的装置。在b中反应的离子方程式为SO32-+2H+= H2O +SO2↑;或HSO3-+H+=SO2↑+H2O;根据反应原理可知在c中的试剂是硫化钠和碳酸钠的混合溶液。(2)反应开始后,c中先发生反应:H2O+SO2+Na2S=H2S+ Na2SO3; SO2+2H2S="3S↓+" 2H2O.S是不溶于水的淡黄色物质。因此有浑浊产生,后又变澄清,发生反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2。(3) H2S 、SO2都是大气污染物。由于它们都是酸性气体,能够与碱发生反应,所以在d中的试剂为强碱NaOH溶液。为防止倒吸现象的发生,在导气管的末端安装了一个干燥管。(4)影响化学反应速率的因素的因素有浓度、温度、滴加速度等。在实验中要控制SO2生成速率,可以采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等。(5)硫代硫酸钠( Na2S2O3)是强碱弱酸盐,与酸容易发生反应。所以若SO2过量,溶液显酸性,产物容易分解。因此不能过量。
