问题
实验题
工业生产的纯碱中常含有少量的NaCl杂质。某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用下图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数。
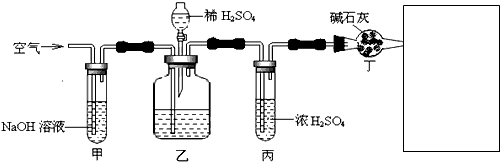
(1)甲装置的作用是____________;甲装置反应的离子方程式是__________________________。
(2)乙装置反应结束后,再通数分钟空气的作用是___________________。
(3)若去掉丙装置,测得的CO2质量会_________(填“偏大”、“偏小”或“无影响”)。
(4)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为_____________________。
(5)有同学认为在丁后面还要加一装置,请分析完成装置图于方框中。
答案
(1)除去空气中的CO2等气体,减小误差;CO2+2OH-==CO32-+H2O
(2)将产生的CO2全部被干燥管里的碱石灰吸收
(3)偏大
(4)
(5)