问题
实验题
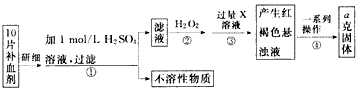
硫酸亚铁晶体 (FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,实验步骤如下:请回答下列问题:
(1)步骤②中加入过量H2O2的目的是____________。
(2)步骤③中反应的离子方程式为________________。
(3)步骤④中一系列处理的操作步骤是:过滤、___________、灼烧、_______________、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为___________g (用含a的代数式表示)。
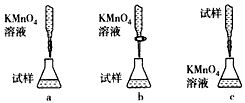
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++ MnO4-+8H+=5Fe3++Mn2+
+ 4H2O)。
某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
(6)正常人每天应补充14 mg左右的铁,其中绝大部分来自食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天需服用约含________mgFeSO4·7H2O的片剂。
答案
(1)将溶液中Fe2+完全转化为Fe3+
(2)Fe3++3OH-=Fe(OH)3↓或Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+
(3)洗涤;冷却
(4)0.07a
(5)b
(6)69.5
