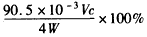亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为_____________。
(2)在ClO2稳定装置中,H2O2作_______ (选填序号)。
A.氧化剂 B.还原剂 C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是___________(按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发 D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以 下操作:

①步骤Ⅱ中发生反应的离子方程式是______________ ,步骤Ⅲ中达到滴定终点时的现象是___________
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数为_____(用字母表示)。
(1)2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(2)B
(3)BCFA
(4)①ClO2-+4H++4I-=2I2+Cl-+2H2O;滴入最后一滴Na2S2O3溶液时,溶液蓝色褪去且半分钟内不恢复;
②