黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示

已知:
①王水是由1体积的浓硝酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程___________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_______(填代号)
A.NaOH B.BaCl2 C.HCl D.Na2SO4
(4)实验室利用下列装置和试剂制取少量氯化氢气体
试剂:①浓硫酸 ②浓盐酸 ③食盐固体
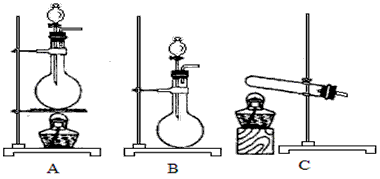
若选用试剂①②,则宜选择的装置是____________。若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为____________________;
(5)方法一中,灼烧时发生反应的化学反应方程式为_____________________;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.4g,不考虑操作误差,则该矿石中FeS2的质量分数是______。
(1)用量筒取3体积的浓盐酸倒入烧杯中,再取1体积的浓硝酸慢慢倒入浓盐酸中,边加边搅拌
(2)玻璃棒
(3)BD
(4)B;A;2NaCl+H2SO4(浓) Na2SO4+2HCl↑或NaCl+H2SO4(浓)
Na2SO4+2HCl↑或NaCl+H2SO4(浓) NaHSO4+HCl↑
NaHSO4+HCl↑
(5)2Fe(OH)3 Fe2O3+3H2O;40%或0.40
Fe2O3+3H2O;40%或0.40
