氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
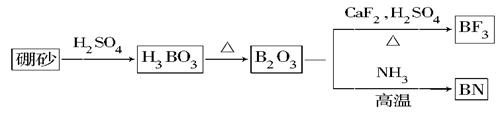
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________、____________________;
(2)基态B原子的电子排布式为________;B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F-B-F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4, 的立体构型为________;
的立体构型为________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为____________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
(1)B2O3+3CaF2+3H2SO4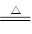 2BF3↑+3CaSO4+3H2O B2O3+2NH3
2BF3↑+3CaSO4+3H2O B2O3+2NH3 2BN+3H2O
2BN+3H2O
(2)1s22s22p1 N +3 (3)120° sp2 正四面体
(4)共价键(极性共价键) 分子间作用力
(5) 4 4 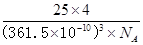
题目分析:(1)根据反应物以及原子守恒可知,该反应的方程式是B2O3+3CaF2+3H2SO4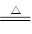 2BF3↑+3CaSO4+3H2O,B2O3+2NH3
2BF3↑+3CaSO4+3H2O,B2O3+2NH3 2BN+3H2O。
2BN+3H2O。
(2)根据工作原理可知,基态B原子的电子排布式为1s22s22p1;非金属性越强,电负性越大,则B和N相比,电负性较大的是N,所以BN中B元素的化合价为+3价。
(3)根据价层电子对互斥理论可知,在BF3分子中B原子含有的孤对电子对数=(3-3×1)÷2=0,所以该分子是平面正三角形结构,则F-B-F的键角是120°,B原子的杂化轨道类型为sp2。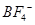 的立体构型为正四面体型结构。
的立体构型为正四面体型结构。
(4)B原子与N原子都是非金属元素,则二者之间的化学键为极性键。根据石墨的结构可知,层间作用力为分子间作用力。
(5)立方氮化硼的晶体结构和金刚石类似,则在其晶胞中含有的氮原子和硼原子的个数都是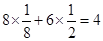 个。晶胞边长为361.5pm,则
个。晶胞边长为361.5pm,则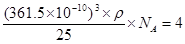 ,解得密度ρ=
,解得密度ρ=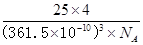 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。也有助于激发学生的学习积极性和学习兴趣。
