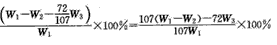问题
实验题
某化学研究性学习小组拟采用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜并测定样品中氧化铜的质量分数,其实验流程如图所示:

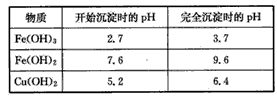
实验过程中的pH调节为:
请回答以下问题:
(1)步骤①、③过滤操作中,除用到仪器:铁架台(带铁圈)、漏斗、烧杯外,还需要使用的仪器用品有________。
(2)步骤①中发生的离子反应方程式为________、____。
(3)步骤②溶液I中加入试剂X可以是____(填下列试剂的编号)。
A.氢氧化钠
B.氯水
C.碱式碳酸铜
D.氧化铜
(4)步骤③中将溶液pH调节到的范围是____。
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·xH2O,其原因是____ 。
(6)经检测,CuCl2·xH2O中含水28. 6%,则CuCl2·xH2O中x的值为____。
(7)若步骤④中80%的氯化铜转入晶体,其余各步转化都是完全的,请根据流程图中表示的质量数据,写出 样品中氧化铜质量分数的计算式。
答案
(1)玻璃棒、滤纸
(2)CuO+2H+==Cu2++H2O;FeO+ 2H+=Fe2++H2O
(3)B
(4)3. 7~5.2
(5)干燥HCl的气 流既可抑制Cu2+的水解,还能带走CuCl2·xH2O受热产生的水 汽
(6)3
(7)