问题
选择题
将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X。测得反应前后物质的质量如下表:
| 物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
| 反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 6.6 | 2.7 | m |
A.表中m的值为13.5 B.该反应属于分解反应
C.物质X能在氧气中燃烧 D.物质X中一定含有氢元素
答案
答案:C
根据质量守恒定律,苯、氧气质量都减少,为反应物,而二氧化碳和水的质量增加为生成物,M苯+M氧气=3.9g+9.6g=13.5g,M二氧化碳+M水="6.6g+2.7g=9.3" g,13.5g >9.3 g,故X反应的质量为m="13.5" g -11.6 g=1.9g,故A、B说法错误;3.9g苯含氢元素质量=3.9g×6/78="0.3g" ,7.2g水含氢元素的质量为2.7g×2/18=0.3g,二者含氢元素质量相等,说明X不可能含有氢元素,D说法错误;2.7g水含氧元素的质量为2.7g×16/18=2.4g, 6.6g二氧化碳含氧元素的质量为6.6g×32/44=4.8g,二者之和2.4g+4.8g=7.2g,故X含有氧元素质量为9.6g-7.2g=2.4g,3.9g苯含碳元素3.9g×72/78=3.6g,6.6g二氧化碳含碳元素的质量为6.6g×12/44=1.8g。则X含碳元素的质量为3.6g-1.8g=1.8g;则X中碳元素与氧元素所含有原子个数为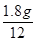 :
: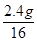 =1:1,故X的化学式为CO,CO能在氧气中燃烧,C说法正确。答案为C。
=1:1,故X的化学式为CO,CO能在氧气中燃烧,C说法正确。答案为C。
