X、Y、Z、W、R为前四周期原子序数依次增大的五种元素,X、Y、Z、W为同一周期相邻元素,Z元素原子核外电子的运动状态共有8种;R元素与比它核电荷数大的另外两种元素位于第四周期同一族。
(1)X的一种核素用于鉴定文物年代,该核素的符号为____。
(2)X、Y、Z、W四种元素第一电离能由大到小的顺序为____(用元素符号表示)。
(3)用氢键表示式写出W的气态氢化物水溶液中不同种分子间存在的氢键____。
(4)Y的一种氢化物分子中共有18个电子,该分子中存在的共价键类型有____(填选项字母)。
A.非极性键;B.极性键;C. 键;D.
键;D.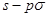 键;E.p—p
键;E.p—p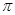 键;F.
键;F.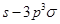 键;G.
键;G.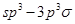 键;H.
键;H.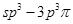 键
键
(5)R的基态原子的价层电子排布式为____,R元素位于周期表的____区。
(6)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示:
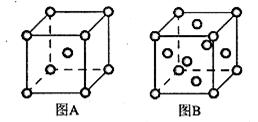
图A中原子堆积方式为 ,A、B中R原子的配位数之比为____。A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为____。
(1)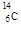 或
或 (2)F、N、O、C (3)F-H…O、O-H…F (4)ABFG
(2)F、N、O、C (3)F-H…O、O-H…F (4)ABFG
(5)3d64s2;d (6)体心立方;2∶3;b3∶2a3
试题解析:Z元素原子核外电子的运动状态共有8种,则Z原子核外共有8个电子,Z为8号元素O,X、Y、Z、W位于同一周期且相邻,则X为C,Y为N,W为F。第四周期同一族有三种元素的只有第VIII族,R的原子序数最小,则R为Fe。
(1)用于鉴定文物年代的C的同位素是14C。
(2)同一周期元素第一电离能自左向右有增大的趋势,但因第VA族元素的p轨道处于半满状态,较稳定,因此第一电离能大于同周期第VIA族元素,故四种元素的第一电离能由大到小的顺序为F>N>O>C。
(3)HF的水溶液中不同分子间存在的氢键有F-H…O、O-H…F。
(4)18电子的氮的氢化物为N2H4。分子中的氮氮键为非极性键,属于 键,氮氢键为极性键,属于
键,氮氢键为极性键,属于 键。
键。
(5)基态Fe的价层电子排布为3d64s2,Fe位于周期表的d区。
(6)A晶胞的堆积方式是体心立方,原子的配位数是8,B晶胞的堆积方式是面心立方,原子的配位数是12,因此A、B中Fe原子的配位数之比为8:12=2:3。A晶胞中含有Fe原子数位2个,晶胞的密度是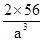 ,B晶胞中含有的Fe原子数为4个,因此晶胞密度为
,B晶胞中含有的Fe原子数为4个,因此晶胞密度为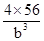 ,二者的密度比为
,二者的密度比为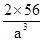 :
: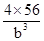 = b3∶2a3。
= b3∶2a3。