甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
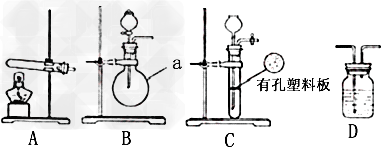
甲小组测得:反应前氧化铜的质量为 、氧化铜反应后剩余固体的质量为 、生成氮气在标准状况下的体积 。乙小组测得:洗气前装置D的质量 、洗气后装置后D的质量 、生成氮气在标准状况下的体积 。请回答下列问题:
(1)写出仪器a的名称:___________。
(2)检查A装置气密性的操作是______________________。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。

(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为___________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是______________________。为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果。该药品的名称是___________。
(1)圆底烧瓶
(2)连接导管,将导管插入水中;加热事关,导管口有气泡产生;停止加热,导管内有水回流并形成一段稳定的水柱
(3)①(NH4)2SO4+Ca(OH)2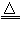 2NH3↑+2H2O+CaSO4;②B;③氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O
2NH3↑+2H2O+CaSO4;②B;③氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O NH3·H2O
NH3·H2O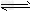 NH4++OH-向逆反应方向移动,加快氨气逸出
NH4++OH-向逆反应方向移动,加快氨气逸出
(4)5V1:7(m1-m2)
(5)浓硫酸吸收了未反应的氨气,从而使计算的氨的含量偏高;碱石灰(氢氧化钠、氧化钙等)
