黄铜是一种铜锌合金,除含铜和锌外,还含有少量铅、铁等杂质。为了测定黄铜中铜的质量分数,设计实验步骤如下。
①称取黄铜屑0.1 g放人小烧杯中;
②用浓硝酸在加热条件下溶解黄铜屑,使Cu、Zn、Pb、Fe转化成Cu2+、Zn2+、Pb2+、Fe3+进入溶液;
③用氨水中和溶液中过量的硝酸(用弱碱调pH确保各种金属阳离子不沉淀),并移入250 mL碘量瓶(带磨口塞的锥形瓶)中;
④加入掩蔽剂NH4HF2溶液,使Fe3+变成不参与反应的[FeF6]3-,然后再加入过量KI溶液,溶液呈黄色,且有白色沉淀产生;
⑤用浓度为0. 06 mol.L-1的Na2S2O3溶液滴定至溶液呈浅黄色时,加入0.2%的某溶液作指示剂继续滴定至终点。 滴定反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。重复滴定3次,平均耗用Na2S2O3溶液的体积为15.80 mL。
(1)滴定实验中所用指示剂是___,实验中用碘量瓶而不用普通锥形瓶是因为___。
(2)写出测定过程中加入过量KI溶液时发生反应的离子方程式:___。
(3)根据已知数据写出计算含铜质量分数的代数式(无需化简)_____。
(4)如果不加NH4HF2会使测定结果___(填“偏高”、“偏低”或“无影响”),原因是____。
(5)溶液中Pb2+、Zn2+不影响实验结果的原因是___。
(1)淀粉溶液;防止空气中的O2氧化I-
(2)2Cu2++4I-=2CuI↓+I2
(3)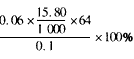
(4)偏高;Fe3+可氧化I-生成I2,使I2的量增加,消耗Na2S2O3的量增多
(5)Pb2+、Zn2+的氧化性比I2的氧化性弱,不能氧化I-
