实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某化学兴趣小组测定其中NH4HCO3的含量。小组的同学设计用在混合物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+→SO42-+Mn2++H2O )
回答以下问题:
(1)化学小组主要选用了下列药品和仪器进行实验(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
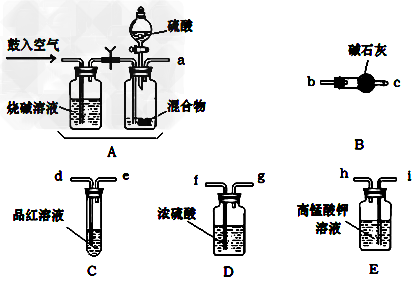
请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
A→ ____→_____→____→____→ f → g →_____→______
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是_______________;加酸后A装置再次鼓入空气的作用是 _______________。
(3)E 装置的作用是:__________________。
(4)实验中,若D瓶中溶液褪色,则测定结果可能会偏___________,为了确保实验中D瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol/L的KMnO4溶液体积(V)不少于 _____________mL;
(5)若混合物样品质量为13.1 g,充分作用后碱石灰增重4.4 g,则混合物中NH4HCO3的质量分数为____________________。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是 ____________________。
(1)“略”
(2)排出装置中原有空气;将生成的气体全部送入后续装置(答使反应产生的CO2和SO2能被完全吸收)
(3)除去SO2,以防止SO2对测定结果的影响
(4)高;50m/(13a)
(5)60.3%
(6)在B之后再接一个阻止空气中水和二氧化碳进入B的装置
