现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.所选用装置的连接顺序应是(填各接口的字母):______.
| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |
计算CaC2的质量分数时,必需用的数据是______.不必作第6次读数的原因是______.此试样中CaC2的质量分数为______.
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下:
①操作Ⅱ的名称是______.
②还需直接测定的物理量是______.
③在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果______(填“偏大”、“偏小”或“不变”).
④请指出该实验方案的2个不足之处______
⑤请改进这个实验方案,至少解决其中1个不足之处______.
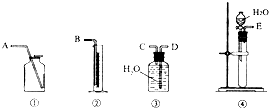
(1)乙炔气体难溶于水可以用排水量气方法测定气体体积,装置的连接顺序是E、C、D、B;
故答案为:装置的连接顺序是E、C、D、B.
(2)在锥形瓶中生成乙炔,气体逸出,剩余物质的质量减小,所以根据称量反应前后锥形瓶和物质的质量变化,得到生成气体的质量,根据化学方程式计算乙炔的质量,得到样品的纯度,所以需要称量反应前锥形瓶和水的质量、样品质量、反应后锥形瓶加水加式样的质量,第4、5次实验读数相同,表明锥形瓶内质量已达恒重,反应进行完全,说明反应在第四次读数时已经结束,
锥形瓶中发生反应CaC2+2H2O→Ca(OH)2+C2H2↑,生成C2H2的质量为(195+1.5)g-196g=0.5g,令CaC2质量为m,则:
CaC2+2H2O→Ca(OH)2+C2H2↑
64g 26g
m 0.5g
所以m=
=64g×0.5g 26g
g,CaC2的质量分数为16 13
×100%=82%.
g16 13 1.5g
故答案为:试样质量、锥形瓶和水的质量、第4、5次读数;第4、5次实验读数相同,表明锥形瓶内质量已达恒重,反应进行完全;82%
(3)①加入盐酸反应后生成氯化钙溶液,实验目的是最后称量氯化钙的质量,应将溶液蒸发,所用仪器为蒸发皿,并用玻璃棒搅拌,加热后所得固体放在干燥器中冷却后称量;
故答案为:蒸发;
②加入盐酸反应后生成氯化钙溶液,实验目的是最后称量氯化钙的质量,需要直接测定CaCl2质量;
故答案为:CaCl2质量.
③在转移溶液时,如溶液转移不完全,会导致测定的氯化钙的质量偏小,令原样品中的氧化钙物质的量为X,碳化钙物质的量为Y,未损耗时称量的氯化钙质量为Z,则得到:56X+64Y=1.6;X+Y=Z/111,整理的Y=0.2-
,所以称量的氯化钙损耗越多,计算得到的碳化钙的质量越大,所占质量分数越大,在转移溶液时,如溶液转移不完全,损耗氯化钙,Z减少,Y增大,CaC2质量分数增大,所以测量结果偏大;7Z 111
故答案为:偏大.
④该实验方案的不足之处:由于CaCl2具有很强的吸水性,称量的不一定是无水CaCl2的质量;CaO和CaC2的摩尔质量接近,实验误差会很大.
故答案为:由于CaCl2具有很强的吸水性,称量的不一定是无水CaCl2的质量;CaO和CaC2的摩尔质量接近,实验误差会很大.
⑤由于CaCl2具有很强的吸水性,称量的不一定是无水CaCl2的质量,可以将Ca2+转化为CaCO3或CaC2O4沉淀,过滤后称其质量.
故答案为:可以将Ca2+转化为CaCO3或CaC2O4沉淀,过滤后称其质量.

 领头雁飞得太慢,混在雁阵里,也会失去领头雁的作用。”这个比喻意在告诫干部要( )
领头雁飞得太慢,混在雁阵里,也会失去领头雁的作用。”这个比喻意在告诫干部要( )