某化学课外小组利用H2还原R2O3粉末测定R元素的相对原子质量,图是测量装置的示意图(加热装置和夹持装置略去),A中的试剂是稀盐酸,B中加入的是锌粒.
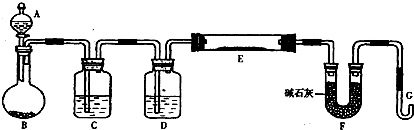
请回答下列问题:
(1)连接好装置后的实验操作依次是______(填操作序号)
①检验氢气纯度 ②加热E ③检验装置气密性 ④点燃G管逸出的气体 ⑤从A瓶逐滴滴加液体
(2)C中的试剂是______,其作用为______.
(3)从G管逸出的气体需要点燃除去的原因是______.
(4)在稀盐酸中加入稍许CuSO4溶液,发现B中产生气体的速度明显加快,你认为原因是______.
(5)该化学课外小组从实验中测得了下列数据:
①空E管的质量a;②E管和R2O3的总质量b;③反应后E管和R粉的总质量c(冷却到温室称量);④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e;
根据以上数据可以列出三个计算R的相对原子质量的不同计算式(除R外,其它涉及的元素的相对原子质量均为已知):
计算式1:Ar(R)=______;
计算式2:Ar(R)=______;
计算式3:Ar(R)=______.
(1)连接好装置后应首先检验装置的气密性,装置E需要加热,而氢气若与空气混合加热易爆炸,故应先从A瓶逐滴滴加液体制取氢气,用制取的氢气将装置中的空气排尽,检验H2的纯度后,点燃G管溢出的气体,然后再加热E,所以顺序为③⑤①④②,故答案为:③⑤①④②;
(2)在H2与WO3反应前必须依次除去氯化氢、水蒸气,氯化氢极易溶于水,可以用水除去,故答案为:水;吸收氢气中的HCl气体;
(3)实验结束后,会有氢气剩余,保证金属氧化物全部消耗,所以最后出来的是氢气,排放到空气中遇火会发生爆炸;
故答案为:防止逸出的氢气遇明火发生爆炸;
(4)锌和硫酸铜反应,铜析出在锌表面,在盐酸溶液中形成原电池反应,加快生成氢气的速率;
故答案为:锌和硫酸铜反应生成铜附着在锌粒表面,在盐酸溶液中形成许多小铜锌原电池,制取氢气的速率加快;
(5)根据H2与R2O3反应的化学方程式,要求W的相对原子质量,可以用固体的质量变化,也可以利用生成的H2O的质量求解.
R2O3+3H2
2R+3H2O △ .
2Ar(R)+48 2Ar(R) 54
b-a c-a e-d
因此
=2Ar(R)+48 b-a
①;2Ar(R) c-a
=2Ar(R) c-a
②;54 e-d
=2Ar(R)+48 b-a
③;54 e-d
分别求解,由①可求得Ar(R)=
;24(c-a) b-c
由②可求得Ar(R)=
;27(c-a) e-d
由③求的Ar(R)=
故答案为:
;24(c-a) b-c
;27(c-a) e-d
-24;27(b-a) e-d