已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.
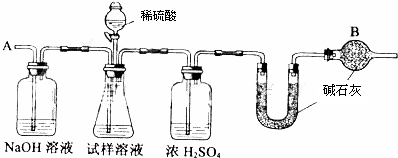
主要步骤如下:
①按图组装仪器,并检查装置的气密性
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol•L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明______
(2)装置中干燥管B的作用是______
(3)如果将分液漏斗中的疏酸接成浓度相同的盐酸,测试的结果______(填偏高、偏低可不变)
(4)步骤⑤的目的是______
(5)步骤⑦的目的是______
(6)该试样中纯碱的质量分数的计算式为______
(7)还可以用其他实验方法测定试样中纯碱的质量分数.请简述一种不同的实验方法.
(1)由于称量时左物右码,依据天平的杠杆原理,向左偏说明样品重,砝码轻;
故答案为:样品重,砝码轻;
(2)U型管中的碱石灰是为了吸收反应生成的二氧化碳,但空气中也存在二氧化碳,干燥管B的作用就是防止空气中的二氧化碳和水分进入U型管,对结果产生误差;
故答案为:防止空气中的CO2和水气进入U型管中;
(3)由于盐酸具有挥发性,也会随着二氧化碳进入U型管,被误认为是二氧化碳,所以二氧化碳的质量偏大,算出的碳酸钠的质量也会偏大的,所以结果会偏大;
故答案为:偏高;
(4)由于反应完了锥形瓶中存留有二氧化碳,鼓入一定量的空气就是将残留的二氧化碳完全排入U型管;
故答案为:把反应产生的CO2全部导入U型管中;
(5)直到U型管的质量基本不变,说明二氧化碳已经被全部排到U型管中;
故答案为:判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收;
(6)设需要碳酸钠的质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X d-b
列比例式
=106 X
;44 d-b
解得X=
;106(d-b) 44
所以试样中纯碱的质量分数的计算式为
×100%;106(d-b) 44a
故答案为:
×100%;106(d-b) 44a
(7)根据用一种试剂与碳酸钠反应产生沉淀,根据沉淀算出碳酸钠的质量:取一定量试样放入烧杯中,加适量蒸馏水溶解,再向烧杯中滴加足量氢氧化钙溶液,将得到的沉淀过滤洗涤干燥后称量,根据方程式由沉淀质量算出碳酸钠质量,再除以样品质量. 故答案为:取一定量试样放入烧杯中,加适量蒸馏水溶解,再向烧杯中滴加足量氢氧化钙溶液,将得到的沉淀过滤洗涤干燥后称量,根据方程式由沉淀质量算出碳酸钠质量,再除以样品质量.

