黄铁矿是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究.
[实验一]测定黄铁矿中硫元素的含量
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
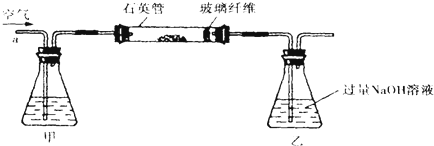
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
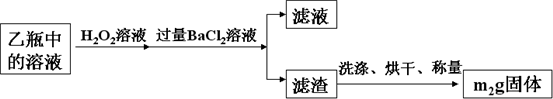
问题讨论:
(1)Ⅰ中,石英管中发生的反应方程式为______.
(2)Ⅱ中,为判断所加BaCl2是否过量,有同学设计了如下实验方案,其中合理的是______
A.取少量上层清液,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量.
B.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量.
C.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量.
D.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量.
(3)该黄铁矿中硫元素的质量分数为______.
[实验二]测定黄铁矿中铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④取稀释液25.00mL,用浓度为0.10mol/L的酸性KMnO4溶液滴定,实验平均消耗KMnO4溶液体积为V mL.
问题讨论:
(4)④中,需要用到的主要仪器有______;
(5)②中,若选用铁粉作还原剂.你认为合理吗?______,理由是______.
(6)黄铁矿中铁元素的质量分数为______.
实验一:(1)Ⅰ中,石英管中二硫化亚铁与氧气反应生成氧化铁与二氧化硫,反应方程式为4FeS2+11O2
2Fe2O3+8SO2, 高温 .
故答案为:4FeS2+11O2
2Fe2O3+8SO2; 高温 .
(2)加入BaCl2溶液是将亚硫酸根转化为硫酸钡沉淀,判断所加BaCl2是否过量方法是:待浊液澄清后,取少量上层清液,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量,
故选C;
(3)m2g是硫酸钡的质量,硫酸钡的物质的量为
=m2g 233g/mol
mol,根据硫元素守恒可知黄铁矿中硫元素的质量为m2 233
mol×32g/mol=m2 233
g,所以硫铁矿中硫元素的质量分数为32m2 233
×100%=
g32m2 233 m1g
×100%,故答案为:32m2 233m1
×100%;32m2 233m1
实验二:(4)步骤④是滴定,需要用到的主要仪器有:铁架台、酸性滴定管、烧杯、滴定管夹、锥形瓶,
故答案为:铁架台、酸性滴定管、烧杯、滴定管夹、锥形瓶;
(5)该方案通过滴定生成生成的Fe2+,确定硫铁矿中铁元素的质量分数,用铁作还原剂会增加铁元素的量,导致测定的硫铁矿中铁元素的质量分数偏高,故不能用铁作还原剂,
故答案为:不合理;用铁作还原剂会增加铁元素的量;
(6)令m1g硫铁矿中铁元素的质量为a,硫铁矿中铁元素的质量对亚铁离子的质量,则:
5Fe2+~MnO4-
280g 1mol
a 0.001VL×0.1mol/L×
=0.001Vmol250mL 25mL
所以a=
×280g/mol=0.28Vg0.001Vmol 1mol
所以硫铁矿中铁元素的质量分数为
×100%=0.28Vg m1
%,故答案为:28V m1
%.28V m1
