黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料.某化学学习小组对某黄铁矿石进行如下实验探究.[实验一]测定硫元素的含量.
Ⅰ、将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2
2Fe2O3+8SO2. 高温 .
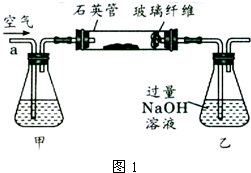
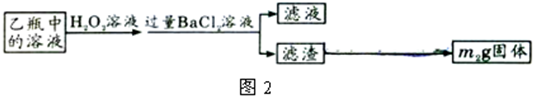
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理.
[实验二]测定铁元素的含量.
Ⅲ、测定铁元素含量的实验步骤如图3所示.

问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是______溶液.乙瓶内发生反应的离子方程式有:______、______.
(2)Ⅱ中的滤渣在称量前还应进行的操作是______.
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是______.
(4)④中取稀释液25.00ml需用的仪器是______.Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有______(画出其简易装置图).
(5)该黄铁矿中硫元素的质量分数为______.
(1)空气中含有二氧化碳,能和乙中的氢氧化钠反应生成碳酸钠,碳酸钠和氯化钡反应生成碳酸钡导致沉淀量增大,从而导致干扰硫元素的测定,所以要把空气中二氧化碳除去,用氢氧化钠或氢氧化钾溶液除去即可,所以甲中盛放的是氢氧化钠溶液或氢氧化钾溶液;
乙中二氧化硫和氢氧化钠反应生成亚硫酸钠,离子方程式为 SO2+2OH-=SO32-+H2O,亚硫酸钠和氧气反应生成硫酸钠,离子方程式为2SO32-+O2=2SO42-,
故答案为:NaOH;SO2+2OH-=SO32-+H2O;2SO32-+O2=2SO42-;
(2)为准确称量固体的质量,在称量之前需洗涤和干燥;故答案为:洗涤、干燥;
(3)为使亚硫酸根离子完全转化为硫酸根离子,加入的双氧水要足量,故答案为:使SO32-完全氧化为SO42-;
(4)④中取稀释液25.00ml,溶液是酸性溶液,体积数据要求到小数点后两位,需用的仪器是酸式滴定管,Ⅲ的步骤③中,一定物质的量浓度溶液的配制中,除了烧杯、玻璃棒、胶头滴管外,还需要250mL容量瓶,容量瓶装置图为:
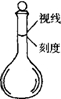
,故答案为:酸式滴定管;250mL容量瓶;
(5)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S-----BaSO4
32g 233g
x m2g
x=
g32m2 233
质量分数=
×100%=32m2 233 m1
×100%;32m2 233m1
故答案为:
×100%.32m2 233m1
