某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3 中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
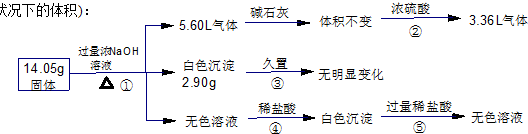
回答下列问题:
(1)写出反应④的离子方程式______.
(2)填写下表中的空白.(注:若混合物中不存在该成分,则“质量”栏中填“0”;画斜线的表格不需填写)
| 成分 | 质量 | 判断依据或计算推理过程 |
| Al | ______ | ______ |
| (NH4)2SO4 | ______ | ______ |
| MgCl2 | ______ | ______ |
| FeCl2 | ______ | ______ |
| AlCl3 | ______ | ______ |
14.05g固体加入过量的氢氧化钠溶液产生气体,可以是铵盐和碱反应生成的氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,5.6L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余3.36L,体积减少5.6L-3.36L=2.24L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为2.24L,剩余的气体只能是氢气,体积为3.36L,说明原混合物中一定含有铝与硫酸铵;
14.05g固体加入过量的氢氧化钠溶液中产生白色沉淀2.9g,久置无变化,Fe(OH)2 在空气中会转化为红褐色Fe(OH)3,判断一定无氯化亚铁,由于氢氧化铝溶于强碱,所以一定含有氯化镁,所以生成白色沉淀是氢氧化镁,质量为2.9g;
14.05g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸 会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,综上所述可知:
(1)反应④是偏铝酸根与氢离子反应生成氢氧化铝沉淀,离子方程式AlO2-+H++H2O=Al(OH)3↓;
故答案为:AlO2-+H++H2O=Al(OH)3↓;
(2)由上述分析可知:混合物一定含有Al、(NH4)2SO4、MgCl2,故:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 67.2L
m(Al) 3.36L
所以m(Al)=54g×
=2.7g 3.36L 67.2L
(NH4)2SO4+2NaOH=2Na2SO4+2H2O+2NH3↑
132g 44.8L
m[(NH4)2SO4]2.24L
所以m[(NH4)2SO4]=132g×
=6.6g2.24L 44.8L
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95g 58g
m[MgCl2]2.9g
所以m[MgCl2]=95g×
=4.75g2.9g 58g
所以三者质量之和为2.7g+6.6g+4.75g=14.05g,故不含AlCl3;
故答案为:
| 成分 | 质量 | 判断依据或计算推理过程 | ||
| Al | 2.7g | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 54g 67.2L m(Al) 3.36L m(Al)=54g× | ||
| (NH4)2SO4 | 6.6g | (NH4)2SO4+2NaOH=2Na2SO4+2H2O+2NH3↑ 132g 44.8L m[(NH4)2SO4]2.24L m[(NH4)2SO4]=132g× | ||
| MgCl2 | 4.75g | MgCl2+2NaOH=Mg(OH)2↓+2NaCl 95g 58g m[MgCl2]2.9g m[MgCl2]=95g× | ||
| FeCl2 | 0 | Fe(OH)2 在空气中会转化为红褐色Fe(OH)3,但步骤③中白色沉淀久置无明显变化 | ||
| AlCl3 | 0 | 原固体中Al、(NH4)2SO4和MgCl2三种物质的质量之和刚好等于14.05g,所以一定没有AlCl3. |
