鸡蛋壳中含有大量钙、少量镁和钾等元素.实验室可用图示流程测定鸡蛋壳中钙、镁元素含量.依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY.回答下列问题.
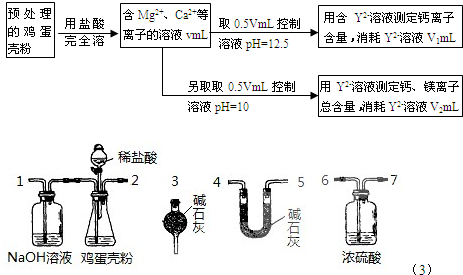
(1)测定Ca2+、Mg2+总含量时,控制溶液pH=10.若pH过大,测定结果将______(填“偏大”、“偏小”或“无影响”);
(2)测定Ca2+含量的关键是控制溶液的pH,使溶液中Mg2+形成沉淀,若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液pH应不小于______(已知:ksp[Mg(OH)2]=1.2×10-11,上述实验均在室温下进行).
(3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是______.
(4)有同学提出可采用如右装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量.
①采用该方法进行实验,各装置从左到右的连接顺序依次1-2-______(填各装置对应接口的数字序号).
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
答:______(填“准确”、“不准确”或“无法判断”).原因是______.
(1)由信息可知,控制pH=10时,溶液中Ca2+、Mg2+都沉淀,控制PH=12.5时,溶液中Ca2+沉淀,Mg2+不沉淀.pH过大时,溶液中镁离子沉淀不完全,所以导致测定结果偏小,
故答案为:偏小;
(2)若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液中氢氧根离子的浓度=
=Ksp C(Mg2+)
mol/L=10-2mol/L,c(H+)=1.2×10-11 1.2×10-7
mol/L=10-12 mol/L,10-14 10-2
所以溶液的pH=12,故答案为:12;
(3)两次消耗Y2+溶液的差即为与镁离子反应的Y2+,所以和镁离子反应的Y2+的物质的量=10-3 C(V2-V1)mol,设镁离子的质量为x.
Mg2++Y2-=MgY
24g 1mol
x 10-3 C(V2-V1)mol
x=0.024C(V2-V1)g
所以镁离子的质量分数=
×100%=0.024C(V2-V1) m 2
%,4.8C(V2-V1) m
故答案为:
%;4.8c(v2-v1) m
(4)①1的作用是吸收空气中的二氧化碳,防止二氧化碳造成干扰,且能把后面各装置中二氧化碳全部排除干净;2的作用是产生二氧化碳;浓硫酸的作用是干燥二氧化碳防止水蒸气干扰测定结果;U型管的作用是吸收二氧化碳,干燥管的作用是吸收空气中的二氧化碳和水蒸气,防止造成干扰,所以各装置从左到右的连接顺序依次1-2-6-7-4-5-3或6-7-5-4-3,
故答案为:6-7-4-5-3或6-7-5-4-3;
②如果蛋壳中钙元素全部以碳酸钙形式存在,且不再含有能与盐酸反应产生酸性气体的其他物质,则测定结果准确;否则不准确,所以测定结果不一定准确,
故答案为:不一定准确;如果蛋壳中钙元素全部以碳酸钙形式存在,且不再含有能与盐酸反应产生酸性气体的其他物质,则测定结果准确;否则不准确.
