根据如图提供的仪器装置,完成提纯并测定Na2CO3样品纯度(其中只含NaHCO3杂质)的实验.
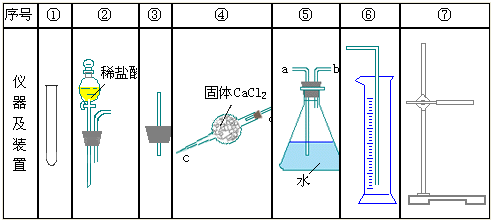
请回答下列问题:
实验一:测定Na2CO3样品中的NaHCO3分解放出的二氧化碳的体积.
(1)连接装置的正确顺序是:______接______接______接______.(写序号)
(2)完成实验一尚缺的仪器是:______.
(3)气体应从装置⑤的______端进入.(写字母)
实验二:测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积.
(4)连接装置的正确顺序是:______接______接______接______(写序号)
(5)当实验一测得产生的二氧化碳为amol,当实验二测得产生的二氧化碳为bmol.则该样品中碳酸钠纯度的实验值为:______.与理论值比较,实验结果______(填:偏大、偏小或相等);若要使实测值更接近于理论值,该实验应怎样改进?______(用文字简要说明)
(1)测定Na2CO3样品中的NaHCO3分解放出的二氧化碳的体积,可将固体混合物放入试管中加热,生成的二氧化碳气体用排水法测量体积,则连接顺序为①③⑤⑥,
故答案为:①③⑤⑥;
(2)反应应在加热条件下进行,实验中缺少酒精灯,故答案为:酒精灯;
(3)用排水法测量气体的体积时,气体应短进长出,故答案为:b;
(4)测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积,应将固体放入试管中,将盐酸放入分液漏斗中,然后用排水法测量气体的体积,连接顺序为①②⑤⑥,
故答案为:①②⑤⑥;
(5)当实验一测得产生的二氧化碳为a mol,当实验二测得产生的二氧化碳为b mol,
反应的相关方程式为,2NaHCO3
Na2CO3+CO2↑+H2O,Na2CO3+2HCl═2NaCl+CO2↑+H2O,△ .
设混合物中含有xmolNaHCO3,ymolNa2CO3,
则有x=2a
x+y=b1 2
解之得y=b-a,
则样品中碳酸钠的质量为106(b-a)g,NaHCO3的质量为84×2a=168ag,
则样品中碳酸钠纯度的实验值为
×100%,106(b-a) 168a+106(b-a)
因二氧化碳微溶于水,导致收集的气体偏小,则与理论值比较,实验结果偏小,应将装置⑤的水换成饱和NaHCO3溶液,
故答案为:
×100%;偏小;将装置⑤的水换成饱和NaHCO3溶液.106(b-a) 168a+106(b-a)

 缺失,余留牙稳固,
缺失,余留牙稳固, 食物嵌塞。
食物嵌塞。