有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.
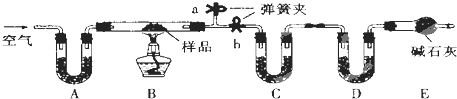
(1)实验时,B中发生反应的化学方程式为______,______.
(2)装置C、D中盛放的试剂分别为:C______,D______(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是______,它在该实验中的主要作用是______
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将______(填“偏高”、“偏低”或“无影响”).
(5)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3•10H2O的质量分数为:______(结果用分数表示,可不化简).
(1)加热时,碳酸氢钠分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3
Na2CO3+H2O+CO2↑;十水碳酸钠分解生成碳酸钠和水,反应方程式为:Na2CO3•10H2O △ .
Na2CO3+10H2O. △ .
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;Na2CO3•10H2O △ .
Na2CO3+10H2O. △ .
(2)C装置是吸收即干燥装置,所以应该盛放吸水的物质,浓硫酸是液体,一般U型管盛放固体,无水氯化钙能吸水,所以C中盛放无水氯化钙;碱石灰能吸收水和二氧化碳,所以D装置盛放碱石灰.
故答案为:无水CaCl2;碱石灰.
(3)该仪器名称是(球形)干燥管;干燥管中盛放的是碱石灰,碱石灰能吸收空气中的水蒸气和二氧化碳,所以干燥管的作用是防止空气中的CO2和水蒸气进入影响测定结果.
故答案为:球形干燥管;防止空气中的CO2和水蒸气进入影响测定结果.
(4)若将A装置换成盛放NaOH溶液的洗气瓶,氢氧化钠溶液中的部分水蒸气进入C装置中,导致水的含量增大,氯化钠的含量偏低.
故答案为:偏低.
(5)D装置中增加的质量为二氧化碳的质量,碳酸氢钠分解生成的水蒸气的质量为x.
2NaHCO3
Na2CO3+H2O+CO2↑ △ .
18g 44g
x m2
x=
gm2×18 44
装置C吸收的是水蒸气,包括碳酸氢钠分解生成的和十水碳酸钠分解生成的,十水碳酸钠分解生成的水蒸气的质量=m1-
g=m2×18 44
g.44m1-18m2 44
设十水碳酸钠的质量为y.
Na2CO3•10H2O
Na2CO3+10H2O △ .
286g 180g
y
g.44m1-18m2 44
y=
g286(44m1-18m2) 180×44
所以十水碳酸钠的质量分数=
×100%=286(44m1-18m2) 180×44 m
×100%.286(44m1-18m2) 180×44m
故答案为:
×100%.286(44m1-18m2) 180×44m
