问题
问答题
已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收).
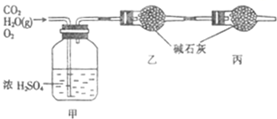
| 实验前 | 实验后 | |
| 甲的质量/g | 101.1 | 103.8 |
| 乙的质量/g | 82.0 | 86.4 |
(1)该燃料分子中碳、氢原子的数目比为______.
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为______.
答案
(1)根据题意,浓硫酸增加的质量是103.8g-101.1g=2.7g,所以有机物燃烧生成水的物质的量为
=0.15mol,碱石灰增加的质量:86.4g-82.0g=4.4g,所以有机物燃烧生成二氧化碳的质量为:2.7g 18g/mol
=0.1mol,根据元素守恒,则该燃料分子中碳、氢原子的数目比为0.1:0.3=1:3,故答案为:1:3;4.4g 44g/mol
(2)该燃料分子的式量为46,每个分子中含有1个氧原子,则碳原子和氢原子的总是量为30,根据碳、氢原子的数目比为3:1,所以碳原子数目为2,氢原子数目为6,其分子式为C2H6O,故答案为:C2H6O.
