氢化钙(CaH2)固体是登山运动员常用的能源提供剂.氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气.氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置.
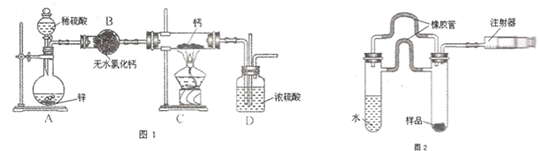
(1)装置B的作用是______;装置D的作用是______;
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,______(请按正确的顺序填入下列步骤的序号).
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是:______.
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度.请完善下列实验步骤.
①样品称量 ②加入______溶液(填化学式),搅拌、过滤 ③______(填操作名称)④______(填操作名称) ⑤称量碳酸钙
(5)乙同学利用图2装置测定上述实验中得到的氢化钙的纯度.他称取46mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处.(上述气体体积均在标准状况下测定)
试通过计算求样品中氢化钙的纯度:______.
(6)请你再设计一种氢化钙纯度的测定方法:______.
(1)氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,H2在发生加热反应之前需要干燥,一般用无水氯化钙,故装置B的作用是:除去氢气中的水蒸气,装置D的作用是:防止空气中的水蒸气进入C装置,
故答案为:除去氢气中的水蒸气;防止空气中的水蒸气进入C装置;
(2)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸,故正确的操作顺序为:②①④③,
故答案为:②①④③;
(3)检验是否干燥用无水硫酸铜,因为无水硫酸铜遇水变蓝色现象很明显,
故答案为:无水硫酸铜;
(4)从最终称量碳酸钙可知,应加入碳酸钠溶液,使CaH2反应的同时得到碳酸钙沉淀,然后经过滤、洗涤、烘干、称量,确定纯度,
故答案为:Na2CO3;洗涤、烘干;
(5)由注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处,可知生成氢气:57.04mL-10mL=47.04mL,所以氢气的质量为:
×2g/mol=0.0042g=4.2mg,设混合物中氢化钙的质量为x,生成氢气质量为y,则钙的质量为46mg-x,钙与水反应生成氢气质量为4.2mg-y,则:0.04704L 22.4L/mol
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
X Y
所以42:4=x:y,整理的y=2x 21
Ca+2H2O═Ca(OH)2+H2↑
40 2
46mg-x 4.2mg-y
所以40:2=(46mg-x):(4.2mg-y),将y=
代入,解得x=42mg,所以样品中氢化钙的纯度为:2x 21
×100%=91.30%,42mg 46mg
故答案为:91.3%
(6)称取一定量的样品(m1g),加入盐酸溶液至不再冒气泡(反应完全),然后将溶液蒸发得到氯化钙固体(m2g),根据m1、m2即可得到氢化钙的纯度,
故答案为:称取一定量的样品(m1g),加入盐酸溶液至不再冒气泡(反应完全),然后将溶液蒸发得到氯化钙固体(m2g),根据m1、m2即可得到氢化钙的纯度.
