现有一定量含有NaOH杂质的Na2O2试样5.00g,分成等质量两份,用两种方法测定Na2O2试样的纯度.请填写下列空白:
(1)第一种方法:取第一份试样,从图1中选用适当的实验装置,设计一个实验以测定过氧化钠的纯度(可供选用的反应物只有CaCO3固体、MnO2固体、6mol•L-1盐酸和蒸馏水).
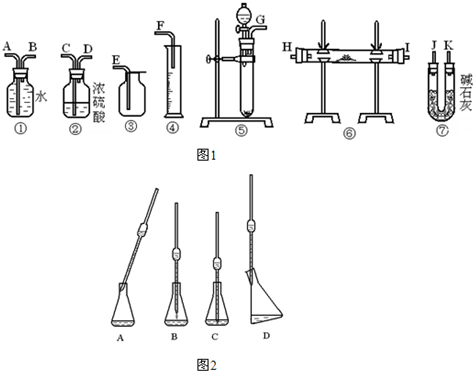
①若实验要求装置尽可能简单,应选用图1中的装置是(只要求写出图中装置的标号)______.
②所选用装置的连接顺序应是(填各接口的字母;连接胶管略).______.
③若实验过程中 * * 生氧气140mL(已折算成标准状况),则试样中过氧化钠的纯度为______.
(2)第二种方法:取第二份试样,配成250.00mL溶液,用0.255 0mol•L-1的标准盐酸滴定.
①取上述所配溶液25.00mL于锥形瓶中,操作如图2所示(手持部分省略):正确的操作是图______,取溶液所用仪器的名称是______.
②滴定操作平行实验的数据记录如下表:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
(3)若上述两个实验中不存在重大的操作失误,测得的实验数据也是真实可靠的,但以上两种方法测得的Na2O2纯度数据误差较大.
①你认为上述两种方法中,哪种方法更为可靠______?
②产生较大实验误差的原因最可能是______.
③在题中所给出的仪器和药品范围内,如何用简单的方法加以改进,使实验误差大为减少,写出改进的方法______.
(1)①、利用过氧化钠与水反应生成氧气,然后排水量气法测定氧气的体积,进而计算Na2O2试样的纯度,故选择⑤①④,
故答案为:⑤①④;
②装置的组装顺序:固体混合物与水反应,吸收生成的氧气中的水蒸气,用排水量气法测定氧气的体积,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积,故连接顺序为:(G)接(A)(B)接(F),
故答案为:(G)接(A)(B)接(F);
③产生氧气140mL,令过氧化钠的质量为mg,则:
2Na2O2+2H2O=4NaOH+O2,
156g 22.4L
mg 0.14L
所以156g:mg=22.4L:0.14L
解得:m=0.975g
所以样品中过氧化钠的纯度为
×100%=39%,0.975g 2.5g
故答案为:39%;
(2)①图中所以的仪器是移液管,将移液管放入接受溶液的容器中,使出口尖端靠着容器内壁,容器稍倾斜,移液管则保持垂直,放开食指,使溶液沿容器内壁自然流下,待移液管内溶液流凈后,再等待片刻,取出移液管,留在管口的少量液体不要吹出,故D正确;
故答案为:D;移液管;
②消耗的盐酸体积为
=25.00mL,根据反应NaOH+HCl=NaCl+H2O可知n(NaOH)=n(HCl)=0.02500L×0.2550mol•L-1×24.98mL+25.00mL+25.02mL 3
=0.06375mol,令样品中氢氧化钠的物质的量为xmol,过氧化钠为ymol,根据二者质量之和与消耗HCl的物质的量有40x+78y=2.5,x+2y=0.06375,联立解得x=0.01375,y=0.025,所以过氧化钠的质量为0.025mol×78g/mol=1.95g,样品中过氧化钠的纯度为250mL 25mL
×100%=78%,1.95g 2.5g
故答案为:78%;
(3)①第一种方法过氧化钠和水反应一部分生成过氧化氢,使氧气不能全部逸出,误差较大,故第二种方法更为可靠,故答案为:第二种方法;
②过氧化钠和水反应一部分生成过氧化氢,使氧气不能全部逸出,误差较大,
故答案为:过氧化钠和水反应一部分生成过氧化氢,使氧气不能全部逸出;
③可以在反应加入二氧化锰做作催化剂,使反应生成的过氧化氢分解生成氧气完全排出,
故答案为:反应前向过氧化钠中加入少量二氧化锰固体.
