某校化学研究性学习小组设计如下实验方案,测定放置己久的小苏打样品中纯碱的质量分数.
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算.实验中加热至恒重的目的是______.
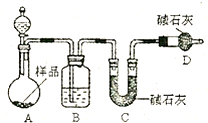
(2)方案二:按图装置进行实验.并回答以下问题.
①实验前先______.分液漏斗中应该装______(“盐酸”或“硫酸”).
D装置的作用是______.
②实验中除称量样品质量外,还需称______装置前后质量的变化.
③根据此实验得到的数据,测定结果有误差.因为实验装置还存在一个明显缺陷,该缺陷是______.
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液.过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯,漏斗外,还用到的玻璃仪器有______.
②实验中判断沉淀是否完全的方法是______.
③已知称得样品21.2g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为______.
(1)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
故答案为:保证NaHCO3全部分解.
(2)①该方案是要获得产生的CO2的质量,在实验前要检查装置的气密性;盐酸具有挥发性,会影响实验结果,所以选择稀硫酸;D干燥管中的碱石灰吸收空气中的水蒸气、二氧化碳,防止进入C被吸收,减少误差.
故答案为:检查装置的气密性;稀硫酸;吸收空气中的水蒸气、二氧化碳,防止进入C被吸收;
②根据所产生的CO2的质量及样品质量,分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数,所以需称量C装置前后质量变化判断生成二氧化碳的质量.
故答案为:C.
③装置A、B中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差;
故答案为:装置A、B中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差;
(3)①过滤操作中,除了烧杯、漏斗外还用到玻璃棒引流.
故答案为:玻璃棒.
②试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
故答案为:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
③此时发生如下反应Na2CO3+BaCl2=BaCO3↓+2NaCl,而NaHCO3与BaCl2则不反应,产生BaCO3沉淀;样品21.2g,干燥的沉淀质量为19.7g,沉淀为碳酸钡沉淀,物质的量为
=0.1mol,碳酸钠物质的量为0.1mol,所以碳酸钠质量分数为19.7g 197g/mol
×100%=50%.0.1mol×106g/mol 21.2g
故答案为:50%;
