问题
填空题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下列问题:
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是
__________________。
(2)不同卤素原子之间可形成卤素互化物,如IBr,BrI3,BrF5,IF7等。其中卤素互化物中的化学键类型
为________。
(3)用价层电子对互斥理论判断BeCl2的构型为____________,BF3分子中B-F键的键角为____________。
(4)CCl4分子中的C原子和NF3分子中的N原子杂化方式是否相同?_____________。如果杂化相同,则其杂化方式为___________;如果杂化不同,则CCl4分子的C原子杂化方式为___________,NF3分子中N原子杂化方式为____________。
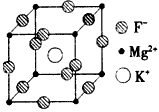
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg 元素的质量分数为_________。
答案
(1)I<Br<Cl<F
(2)共价键(或σ键)
(3)直线形;120°
(4)相同;sp3
(5)20%
