某研究性学习小组的同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.已知:SO2与酸性KMnO4溶液(Mn2+在溶液中近无色)发生反应:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的酸性KMnO4溶液反应进行定量分析.
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽.
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后.
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议.
请你参与该研究性学习小组的活动并发表你的见解:
(1)该小组的同学拟用下列装置定量分析空气中SO2的含量:
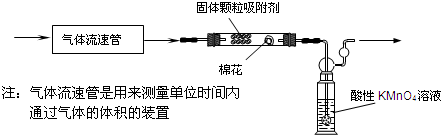
①通入空气前应进行的实验操作是______;
②当看到实验的现象为______时,应停止通空气.
③实验过程中需测量并记录的数据:______.
(2)图是该小组同学根据实验测得的县城不同地区空气中SO2含量:
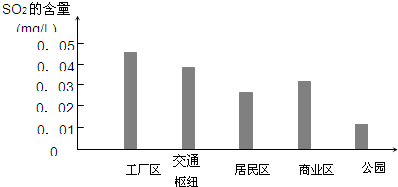
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是______;
②请你向当地有关部门提出一条减少厂区SO2排放的建议______.
(3)下表是该小组同学测得的不同天气情况下的县城空气中SO2的平均含量.请你分析雨后或风速较大时SO2平均含量较低的原因:
| 天气情况 | 平均风速(m/s) | 空气中SO2的平均含量(mg/L) |
| 雨前 | 2.0 | 0.03 |
| 雨后 | 2.2 | 0.01 |
| 晴 | 23 | 0.015 |
| 晴 | 0.9 | 0.03 |
②:______.
(1)①实验前应检查装置的气密性,以确保装置不漏气,以防止影响结构,故答案为:检查装置的气密性;
②KMnO4具有强氧化性,二氧化硫具有还原性,两者发生反应,所以看到KMnO4溶液刚好褪色时,说明二氧化硫和恰好KMnO4溶液完全反应,应停止通空气,故答案为:KMnO4溶液刚好褪色;
③二氧化硫的物质的量可以根据KMnO4的物质的量进行求出,而空气的体积需要知道单位时间内空气的流速和时间来计算,所以需要知道酸性KMnO4溶液刚好褪色所需要的时间,故答案为:通入空气至酸性KMnO4溶液刚好褪色所需要的时间;
(2)①因工厂尾气中含有大量的SO2、汽车尾气中SO2含量也较高,所以工厂区、交通枢纽SO2含量明显高于其他地区,故答案为:工厂尾气、汽车尾气中SO2含量较高;
②SO2来源于化石燃料的燃烧,可通过环保能源来减少SO2的排放,故答案为:改用更洁净的能源(其他合理答案均可);
(3)①SO2能和水反应,所以雨后空气中SO2的含量降低,故答案为:可能是下雨时SO2和水反应降低了雨后空气中SO2的含量;
②风速越大,气体扩散速度越大,SO2浓度也就越小,故答案为:风速越大,气体扩散速度越大,空气中SO2浓度越小.
