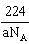问题
填空题
氧是底壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为______个 。
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为__________________________。
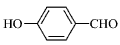 的沸点比
的沸点比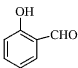 高,原因是________________________________。
高,原因是________________________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为_________。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag·cm-3,NA表示阿伏加罗常数,则CaO晶胞体积为_________cm3
答案
(1)2
(2)O-H键、氢键、范德华力;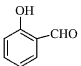 形成分子内氢键,而
形成分子内氢键,而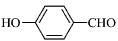 形成分子间氢键,分子间氢键使分子间作用力增大
形成分子间氢键,分子间氢键使分子间作用力增大
(3)sp3;H2O中O原子有2对孤对电子,而H3O+中O原子有1对孤对电子,排斥力小。
(4)