某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
(1)甲同学拟用右图装置测量样品与足量稀盐酸反应生成CO2的体积,来分析CaCO3的含量.则①X的作用是______
②B中不可改用饱和Na2CO3溶液,用离子方程式说明理由______
(2)乙同学拟用以下操作测定样品中CaCO3含量:
A.配制0.100mol/LHCl溶液和0.100mol/LNaOH溶液
B.取一粒药片(0.100g),研碎后加入20mL蒸馏水
C.加入30mL0.100mol/L的盐酸,充分反应
D.用0.100mol/LNaOH溶液中和过量的盐酸至中性,共消耗NaOH溶液18.00mL
试回答下列问题:
①配制0.100mol/LHCl溶液100mL需要的玻璃仪器是______
②该胃药中CaCO3的质量分数是______
(3)甲同学将实验中获得的17.92mLCO2(标准状况)通入10mL0.100mol/LNaOH溶液中,判断所得溶液的溶质是______(填化学式)
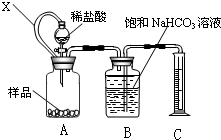
(1)①连通管X能使漏斗和广口瓶中的压强保持一致,使盐酸顺利流下,故答案为:使广口瓶内与分液漏斗内气体压强相等,便于溶液顺利流下;
②若用碳酸钠溶液,溶液中会发生反应:CO32-+CO2+H2O=HCO3-,导致生成的二氧化碳被消耗,测定结果偏小,故答案为:CO32-+CO2+H2O=HCO3-;
(2)①配制0.100mol/L HCl溶液100mL需要的玻璃仪器有100mL容量瓶、烧杯、胶头滴管、玻璃棒,故答案为:100mL容量瓶、烧杯、胶头滴管、玻璃棒;
②反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为18.00 mL,则与碳酸钙反应的盐酸为30.00mL-18.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑可知,100g:2mol=m(CaCO3):0.100 mol/L×0.012L,解得:m=0.06 g,碳酸钙的质量分数为
×100%=60%,故答案为:60%;0.06g 0.1g
(3)标况下,17.92mL CO2 的物质的量是
×10-3mol=0.0008mol,10mL0.100mol/L NaOH溶液中含有氢氧根离子的物质的量是0.01L×0.100mol/L=0.001mol,17.92 22.4
根据关系式:CO2~Na2CO3~2OH-、CO2~NaHCO3~OH-,完全生成碳酸钠,需要消耗氢氧根离子0.0008mol×2=0.0016mol>0.001mol;完全生成碳酸氢钠,需要消耗氢氧根离子的物质的量是:0.0008mol<0.001mol,氢氧根离子有剩余,所以溶液中溶质是碳酸钠和碳酸氢钠的化合物,
故答案为:Na2CO3、NaHCO3.
