开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的.
(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是______.
乙是一种清洁燃料,工业上可用甲和氢气反应制得.
①T1温度时,在体积为2L的密闭容器中充入2mol甲和6mol H2,反应达到平衡后,测得c(甲)=0.2mol/L,则乙在平衡混合物中的物质的量分数是______.
②升高温度到T2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是______(填字母).
A.加入2mol甲 B.充入氮气 C.分离出乙 D.升高温度
(2)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的______倍(计算结果保留1位小数).
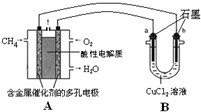
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是______.
②当线路中有0.1mol电子通过时,______(填“a”或“b”)极增重______g.
(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,1个乙分子中含有18个电子,则乙分子中含有1个C原子、1个O原子,则含有H原子数目为18-6-8=4,故乙为CH3OH,分子中均有氧,故甲为CO,
故答案为:CO、CH3OH;
①、发生反应CO (g)+2H2(g)⇌CH3OH(g),应达到平衡后,测得c(甲)=0.2mol/L,则平衡时n(甲)=2L×0.2mol/L=0.4mol,则:CO (g)+2H2(g)⇌CH3OH(g),
开始(mol):2 6 0
变化(mol):1.6 3.2 1.6
平衡(mol):0.4 2.8 1.6
CH3OH在平衡混合物中的物质的量分数为=
=1.6mol 0.4mol+2.8mol+1.6mol 1 3
故答案为:
;1 3
②、该反应为放热反应,
A.加入2mol甲,平衡向正反应移动,但甲的转化率降低,故A错误;
B.充入氮气,反应混合物各组分的浓度不变,平衡不移动,甲的转化率不变,故B错误;
C.分离出乙,平衡向正反应移动,甲的转化率增大,故C正确;
D.T1温度时平衡常数为
=1.6 2
×(0.4 2
)22.8 2
>1,故升高温度平衡向逆反应移动,甲的转化率降低,故D错误;100 49
故答案为:C;
(2)已知:①、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1;
②、2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1,
利用盖斯定律,①×2-②可得:2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H=-1214.6kJ•mol -1
故甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的
=0.7,1214.6kJ 890.3kJ×2
故答案为:0.7;
(3)①、原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+,
故答案为:CH4-8e-+2H2O=CO2+8H+;
②、B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,故在b电极析出Cu,b电极的质量增重,转移0.1mol电子,析出铜的物质的量为
=0.05mol,故析出铜的质量为0.05mol×64g/mol=0.32g,0.1mol 2
故答案为:b;0.32.
