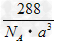问题
填空题
(三选一)【化学--选修 物质结构与性质】
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下
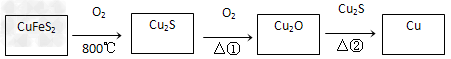
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是_____________、_______________。
(2)基态铜原子的核外电子排布式为_______________,硫、氧元素相比,第一电离能较大的是_______ 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是____________,分子的空间构型是__________________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_________________;在该晶体中存在化学键的种类有_________ 。
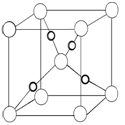
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为_________ g/cm3(用NA表示阿伏加德罗常数的数值)。
答案
(1)2Cu2S+3O2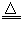 2Cu2O+2SO2;2Cu2O+Cu2S
2Cu2O+2SO2;2Cu2O+Cu2S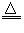 6Cu+SO2↑
6Cu+SO2↑
(2)1s22s22p63s23p63d104s1或[Ar]3d104s1;氧
(3)sp2;V型
(4)乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而降低溶质的溶解度;离子键、配位键、共价键
(5)