一定温度下,向体积为2L的恒容密闭容器中充入1mol PCl5(g),发生反应:
PCl5(g)⇌PCl3(g)+Cl2(g)△H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示.下列说法正确的是( )
A.3s内的平均速率为:V(PCl3)=0.1mol•L-1•min-1
B.达到平衡时放出0.6QKJ热量
C.其他条件不变,再向容器中充入1molPCl5(g),则达新平衡时,C(PCl5)>0.4mol•L-1
D.其他条件不变,增大PCl5的浓度,平衡常数减小
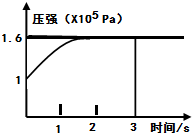
A.恒温、恒容的密闭容器中,气体的物质的量之比等于压强之比,则平衡时混合气体的物质的量为1.6mol,气体的物质的量增大(1.6-1)mol=0.6mol,设生成PCl3的物质的量为x,
PCl5(g)⇌PCl3(g)+Cl2(g) 气体增加的物质的量
1mol 1mol
x 0.6mol
x=
mol=0.6mol,1×0.6 1
V(PCl3)=
=△n V △t
=0.1mol/(L.s),时间单位是S不是min,故A错误;0.6mol 2L 3s
B.该反应是吸热反应不是放热反应,当气体增加1mol时吸收的热量是QKJ,则气体增加0.6mol时吸收的热量是0.6QKJ,故B错误;
C.平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,压强增大,平衡向逆反应方向移动,则平衡浓度大于原来的两倍,故C正确;
D.温度不变,平衡常数不变,故D错误;
故选C.
