问题
选择题
以下为在浓盐酸中H3AsO3与SnCl2反应的离子方程式,关于该反应的说法正确的组合是:( )
a SnCl2+b Cl-+c H3AsO3+d H+=e As+f SnCl62-+g M
①氧化剂是H3AsO3; ②M为OH-;
③每生成7.5gAs,还原剂失去的电子为0.3 mol; ④ SnCl62-是氧化产物。
A.①③④
B.①②④
C.①②③④
D.只有①③
答案
答案:A
Sn元素由+2价升至+4价,SnCl62-是氧化产物,而As元素由+3价降至0价,氧化剂是H3AsO3;
由化合价的升降守恒得:3SnCl2+b Cl-+2H3AsO3+d H+=2As+3SnCl62-+g M,再由由电荷守恒及原子守恒可得:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6H2O
故每生成7.5gAs,还原剂SnCl2失去的电子为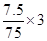 =0.3mol
=0.3mol
由于溶液为强酸性溶液,M不可能为OH—,排除②
答案为A
