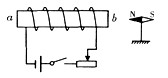
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4Cl与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为______。
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______。
(3)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)=______。
(4)在本实验中,使测定结果Ar(Cu)偏大的是______(填序号)。
①CuO未完全起反应;②CuO不干燥;③CuO中混有不反应的杂质;④碱石灰不干燥;⑤NH4Cl和Ca(OH)2混合物不干燥。
(5)在本实验中,还可通过测定______和______或______和______达到实验目的。
参考答案:
(1)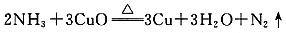
(2)f→g→b→c→f→g(其中f与g,b与c的位置可颠倒)
(3)18a/b—16
(4)①③
(5)m(CuO) m(Cu) m(Cu) m(H2O)(前一种更好)
解析:
(1)氨气还原炽热氧化钠的化学方程式为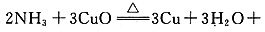 N2↑。
N2↑。
(2)根据反应原理不难得出装置连接顺序为a→f→b→c→f→g。
(3)设Ar(Cu)=x,则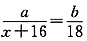 ,即
,即 。
。
(4)CuO未完全起反应使得生成水的质量偏小,即b偏小,故测得x偏大;CuO中有不反应杂质,是由于a偏大,故x偏大。
(5)除实验方式外,只要知道Cu对应的物质的量和Cu对应的质量均可求Ar(Cu)。故可以通过测定m(CuO)和m(Cu)或m(Cu)和m(H2O)。