下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
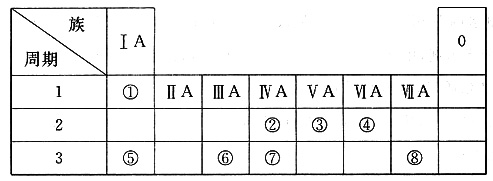
(1)④、⑤、⑥的原子半径由大到小的顺序是______。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______。
(4)由表中两种元素的原子按I:I组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)______。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
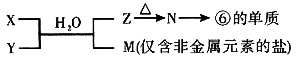
X溶液与Y溶液反应的离子方程式为______。
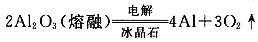
N→⑥的单质的化学方程式为______。
常温下,为使0.1mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至______。
参考答案:
(1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3
(3)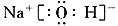 或
或
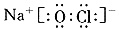
(4)a、b
(5)
 溶液的pH等于7
溶液的pH等于7
解析:
本题涉及元素在周期表中的位置与原子结构、元素性质的关系。根据各元素在周期表中的位置,推出各元素依次为:①H、②C、③N、④O、⑤Na、⑥Al、⑦Si、⑧Cl。
(1)Na、Al是第三周期元素,O在第二周期,所以原子半径:Na>Al>O。
(2)因为非金属性:N>C>Si,所以酸性:HNO3>H2CO3>H2SiO3。
(3)H、O、Na、Cl形成的符合条件的物质很多,比较容易写出电子式的有NaOH、NaClO。
(4)该液态物质是H2O2,MnO2、FeCl3可以作H2O2分解的催化剂。
(5)⑥的单质是Al,逆推得N为Al2O3,Z为Al(OH)3;因为M是仅含非金属元素的盐,所以M是铵盐,由此推出X、Y对应的物质是氨水和铝盐,铝盐可能是AlCl3或Al(NO3)3。M可能是NH4Cl或NH4NO3,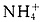 可以水解,要使其溶液中M电离的阴、阳离子浓度相等,则根据电荷守恒得c(OH-)=c(H+),即溶液应为中性。
可以水解,要使其溶液中M电离的阴、阳离子浓度相等,则根据电荷守恒得c(OH-)=c(H+),即溶液应为中性。
