问题
选择题
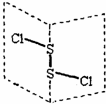
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中不正确的是( )
A.S2Cl2的电子式为
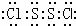
,是极性分子
B.S2Cl2分子中既有有极性键又有非极性键
C.S2Br2与S2Cl2结构相似,稳定性S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
答案
A、由结构可知,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,S2Cl2的电子式为

,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,故A正确
B、S2Cl2分子中S-S为非极性键,S-Cl键为极性键,故B正确;
C、S2Br2与S2Cl2的组成与结构相似,原子半径Br>Cl,故键长S-Br>S-Cl,化学键S-Cl更稳定,故稳定性S2Br2<S2Cl2,故C错误;
D、S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),符合氧化还原反应原理,故D正确;
故选C.
