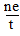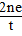用98%的浓H2SO4(ρ=1.84g/cm3)配制 240mL0.5mol/L的稀H2SO4,请按要求填空:
(1)请写出该实验的实验步骤
①______,②______,③______,④______,⑤______.
(2)所用浓H2SO4的物质的量浓度为______,配制时所需浓硫酸的体积为______mL.(均保留一位小数)
(3)实验中需要用到的定量仪器有(包括规格)______
(4)若实验中出现下列现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
①浓硫酸溶解后未冷至室温即进行转移、定容.(______)②定容时俯视刻度线.(______)
(5)若定容时液面高于刻度线应采取的措施是______.
(6)若实验操作全部无误,最后所得的溶液应存放在试剂瓶中,并贴上标签,请你帮助把标签上的内容写一下(如图).______.

(1)根据溶液的配制原理可知,用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀.
故答案为:计算、称量、溶解转移、洗涤转移、定容摇匀.
(2)C=
=103ρ×98% M
mol/L=18.4mol/L;103×1.84×98% 98
设所需浓硫酸的体积为v,所以18.4mol/L×V=0.25L×0.5mol/L,V=0.0068L=6.8mL.
故答案为:18.4mol/L;6.8mL.
(3)量取6.8mL浓硫酸需用10mL量筒;配制240mL稀硫酸需用250mL容量瓶,所以实验中需要用到的定量仪器有(包括规格)10mL量筒、250mL容量瓶.
故答案为:10mL量筒、250mL容量瓶.
(4)根据C=
=n V
判断.m MV
①浓硫酸溶解后未冷至室温即进行转移、定容,溶液有热胀冷缩的性质,导致溶液的体积偏小,所以配制的溶液浓度偏高.
②定容时俯视刻度线,导致溶液的体积偏小,所以配制的溶液浓度偏高.
故答案为:偏高;偏高.
(5)因实验操作过程中一旦出现错误必须重新配制,故答案为:重新配制;
(6)标签上的内容应写出物质的名称和浓度,故答案为:

.