I.实验室用Na2CO3•10H2O晶体配制50g 质量分数为21.2%的Na2CO3溶液.回答下列问题:
(1)应用托盘天平称取Na2CO3•10H2O晶体______ g.
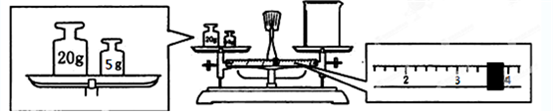
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时犯了一个错误是______.实际称量的碳酸钠晶体质量为______g.
II.实验室要配制2.5mol/L 的稀硫酸溶液90mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84g/cm3的浓硫酸______mL.
(2)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是______.
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是______.
A.用量筒量取浓硫酸时俯视
B.稀释硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥.
I.(1)实验室配制50g 质量分数为21.2%的Na2CO3溶液,需要Na2CO3的质量为:50×21.2%=10.6克,Na2CO3的物质的量为0.1mol,Na2CO3的物质的量和Na2CO3•10H2O的物质的量相等,Na2CO3•10H2O的物质的量为0.1mol,Na2CO3•10H2O的质量为:0.1mol×286g/mol=28.6g,故答案为:28.6g;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得碳酸钠晶体的质量为25g-3.6g=21.4g.
故答案为:砝码和物品位置颠倒;21.4g;
II.(1)实验室无90ml容量瓶,须按100ml容量瓶计算,根据C浓×V浓=C稀×V稀,2.5mol/L×0.1L=
,V=13.6mL,故答案为:13.6;VmL×1.84g/cm3×98% 98g/mol
(2)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般量筒量取浓硫酸,把浓硫酸倒入烧杯进行溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,配成100mL溶液,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、100mL容量瓶,所以还需要玻璃棒、胶头滴管、100mL容量瓶,故答案为:玻璃棒、胶头滴管、100mL容量瓶;
(3)A.用量筒量取浓硫酸时俯视.用量筒量取液体时,俯视读数,使所读液体的体积偏小,使配制的溶液浓度偏小,故A错误;
B.稀释硫酸时,未冷却到室温即转移到容量瓶中.液体具有热胀冷缩的性质,溶解后没有冷却到室温直接转移到容量瓶,冷却后会导致所配溶液的体积偏小,所配溶液浓度偏高,故B正确;
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.量筒在设计时就考虑了不洗涤带来的误差,所以,洗涤量筒只能使配制的浓度偏大,故C正确;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,定容、摇匀、静置后发现凹面低于刻度线又加水至刻度线,溶液的体积偏大,浓度偏小,故D错误;
E.容量瓶不干燥.容量瓶洗涤后内壁有水珠而未作干燥处理,溶液的体积不变,浓度不变,故E错误;
故选BC.
