问题
填空题
实验室欲配制90mL浓度为1.00mol•L-1的Na2CO3溶液:
(1)配制时的实验步骤为:计算、称量、溶解、转移(洗涤)、______、摇匀;
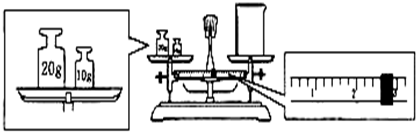
(2)某同学欲称量Na2CO3的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为______g,要完成本实验该同学应称出______ g Na2CO3.
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)
①转移溶液时玻璃棒插在了刻度线以上的位置______;
②容量瓶不干燥,含有少量蒸馏水______.
答案
(1)配制实验操作顺序为:称量、溶解、冷却、移液、洗涤、定容以及摇匀等操作,故答案为:定容;
(2)左盘内质量为30g,游码的数值为2.6g,所以烧杯的实际质量为30g-2.6g=27.4g.没有90mL容量瓶,选择规格相近的容量瓶,故溶液应配制100mL,所以配制100mL1.00mol•L-1的Na2CO3溶液需要Na2CO3质量为:1.00mol/L×0.1L×106g/mol=10.6g,故答案为:27.4;10.6;
(3)①转移溶液时玻璃棒插在了刻度线以上的位置,刻度线以上有液体悬挂,定容后所配溶液体积偏大,所配溶液浓度偏低,故答案为:偏低;
②配制最后需要定容,容量瓶不干燥,含有少量蒸馏水,对所配溶液浓度无影响,故答案为:无影响.
