实验室制配0.5mol/L的NaOH溶液500mL,有以下仪器:①烧杯 ②100mL量筒③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥试管 ⑦药匙
(1)配制时,必须使用的仪器有______(填代号)还缺少的仪器是______.
(2)实验两次用到玻璃棒,其作用分别是:______、______.
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀⑤转移⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为______.
(4)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______.
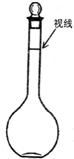
②某同学观察液面的情况如图所示,则所配置的溶液的浓度______.
(5)取出其中50ml溶液加水稀释到100ml,稀释后溶液中NaOH的物质的量浓度为______.
(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以提供的仪器中必须使用有:①烧杯、④500mL容量瓶、⑤玻璃棒、⑦药匙.
缺失的仪器为:托盘天平、胶头滴管.
故答案为:①④⑤⑦;托盘天平、胶头滴管.
(2)有(1)中溶液配制操作可知,玻璃棒的作用为:搅拌;引流.
故答案为:搅拌;引流.
(3)由(1)中溶液配制操作可知,正确的操作顺序为②①③⑧⑤⑥⑤⑦④.
故答案为:②①③⑧⑤⑥⑤⑦④.
(4)①摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
故答案为:偏低.
②由图可知定容时俯视刻度线,导致所配溶液体积偏小,所以所配溶液浓度偏高.
故答案为:偏高.
(5)根据稀释定律,稀释前后溶质的物质的量不变,来计算稀释后溶液中氢氧化钠的物质的量浓度,设令稀释后NaOH的物质的量浓度为c,则50mL×0.5mol/L=100mL×c,解得:c=0.25mol/L.
故答案为:0.25mol/L.
