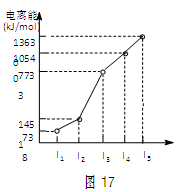
(14分)X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图17所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素。回答下列问题:
(1)已知Y元素的电负性为1.2,氮元素的电负性为3.0,则Y与氮形成的化合物的化学式为 ,该化合物的晶体类型为
(2)电负性:X ______Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。有关Z2H4分子的说法正确的是__________(填字母)。
A.分子中含有氢键
B.分子中既含有极性键又含有非极性键
C.含有4个σ键和1个π键
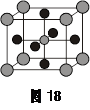
D.属于非极性分子(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构示意图如图18所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围________(填数字)个氧离子相紧邻。
(5)X的氧化物的熔点比Y的氧化物的熔点 (填“高”或“低”),
原因是 。
(14分,每空2分)(1)Mg3N2 (2分) 离子晶体 (2分)
(2)< (2分)(3)B、D (2分) (4)12 (2分)(5)低(2分)CaO、MgO都是离子晶体,Ca2+半径比Mg2+大,CaO晶格能小,熔点低 (2分)
根据X的电离能可知,X的最高价是+2价,所以X是钙,则Y是镁。Z元素是形成化合物种类最多的元素,所以Z是碳元素。
(1)镁的最高价是+2价,氮元素的最低价是-3价,二者都是活泼的金属和非金属,所以形成的化学键是离子键,化合物是离子化合物,化学式为Mg3N2。
(2)金属性越强,电负性越小,所以X的电负性小于Y的。
(3)化学式为Z2H4的应是乙烯,碳元素不能形成氢键,A不正确,B正确,C不正确,分子中含有碳碳双键,所以应该是5个σ键和1个π键,D正确,答案选BD。
(4)钛离子在顶点处,而氧离子在面心处,所以钛离子和周围3×8÷2=12铬氧离子相紧邻。
(5)CaO、MgO都是离子晶体,Ca2+半径比Mg2+大,CaO晶格能小,熔点低。
